CALIDAD DE VIDA Y CÁNCER DE PRÓSTATA: UN PROGRAMA PROGRESIVO DE FUERZA-RESISTENCIA
Serdà, B.C.1; Monreal, P.2 y del Valle, A.2
Grupo de investigación ECIS. Universitat de Girona (UdG). Spain.
1 Departamento de Enfermería bernat.serda@udg.edu
2 Departamento de Psicología pilar.monreal@udg.edu; a.delvalle@udg.edu
Código UNESCO: 3201 Ciencias clínicas
Clasificación del Consejo de Europa: 11 Medicina del deporte
Recibido 18 noviembre de 2009
Aceptado 22 diciembre de 2009
Serdà, B.C.; Monreal, P. y del Valle, A. (2011). Calidad de vida y cáncer de próstata: un programa progresivo de fuerza-resistencia. Revista Internacional de Medicina y Ciencias de la Actividad Física y el Deporte vol. 11 (42) pp. 362-383.
RESUMEN
Este artículo presenta el diseño y la implementación de un programa progresivo de fuerza-resistencia adaptado al cáncer de próstata. El modelo base corresponde a la guía de la American College Sports Medicine Position Stand (ACSM, 2009). La adaptación y transformación del programa incluye los síntomas más habituales relativos a la enfermedad y sus tratamientos. El diseño del estudio es cuasiexperimental. La muestra es de 33 participantes en fase de tratamiento. Las variables de estudio son: clasificación tumoral TNM, variables antropométricas, fuerza-resistencia, tensión arterial, fatiga, incontinencia, dolor y calidad de vida. Al finalizar 24 semanas de programa, se observa una mejora significativa de la capacidad de la fuerza-resistencia. También mejora la hipertensión arterial, la incontinencia urinaria, el dolor y la calidad de vida. Estos resultados demuestran que la mejora de la Calidad de Vida viene mediada por la mejora de la capacidad física y funcional del enfermo.
PALABRAS CLAVE: Programa fuerza-resistencia; Calidad de vida; Cáncer de próstata; Hipertensión arterial; Incontinencia urinaria.
ABSTRACT
This article presents the design and implementation of a progressive resistance strength program adapted to prostate cancer. The initial model corresponds to the guide of the American College Sports Medicine Position Stand (ACSM, 2009). This program includes the most usual symptoms related to the illness and its treatments. The study design is quasi-experimental. The sample is 33 subjects in treatment phase. Study variables are tumour classification TNM, anthropometric measures, resistance strength, hypertension, fatigue, incontinence, pain and quality of life. After 24 weeks a significant improvement on resistance strength capacity is observed. This result is more consistent in lower extremities. Also improves hypertension, urinary incontinence, pain and quality of life. As a conclusion, the improvement of the quality of life is mediated by the functional and physical capacity of the ill person.
KEY WORDS: Resistance strength program; Quality of life; Prostate cancer; Hypertension; Urinary incontinence.
INTRODUCCIÓN
El cáncer de próstata es el cáncer más frecuente en los hombres en muchos países industrializados. En Europa ocupa el segundo lugar después del cáncer de pulmón. En Cataluña, desde 1996, la incidencia del cáncer de próstata ha superado al número de casos del cáncer de pulmón (Pla Director d’Oncologia, 2008). El principal factor de riesgo es la edad, aunque se han identificado otras causas observadas como las influencias ambientales y los estilos de vida (Hsing y Devesa, 2001).
La media de edad en fase de diagnostico es de 75 años. El porcentaje de supervivencia relativa a los 5 años es 76,5%. El estado de morbilidad que generan los tratamientos es muy elevado. Estos factores justifican que, actualmente, el objetivo prioritario en la intervención sociosanitaria sea la mejora de la Calidad de Vida (CdV) del hombre mayor con cáncer de próstata (Fallowfield, 2008).
La Calidad de Vida (CdV) es un concepto multidimensional subjetivo, dinámico, de paradigma modular y de difícil medida (Cella, 1995). La CdV relativa al cáncer (CDVRC) es la experiencia subjetiva de la enfermedad en relación a las expectativas, valores e intereses individuales (Ferrans, 1996) y corresponde con la dialéctica que se establece entre aspectos subjetivos y objetivos. El resultado de esta relación determina la satisfacción del enfermo con el funcionamiento actual (Cella y Tulsky, 1993).
El impacto de la enfermedad incluye dos fases asimétricas. La fase Inicial (erradicación del cáncer) afecta la dimensión física y funcional, con presencia de fatiga, incontinencia urinaria e impotencia sexual. La regresión de la condición física y funcional se valora a partir de la evaluación de las variables de fuerza muscular, densidad mineral ósea, flexibilidad muscular, masa magra versus grasa global y abdominal, síndrome metabólico incluyendo el perfil de lípidos, la eficacia cardiovascular y la hipertensión arterial (Courneya et al., 2007). Posteriormente, continúa la fase post-estrés que vulnera la dimensión psicológica y social con la presencia de distrés y aislamiento social (Korfage et al., 2006). El resultado es la disminución multidimensional, continua y regresiva de la CdV del afectado (Bellizzi et al., 2008).
El corpus actual de la investigación científica demuestra que el diseño de un programa de ejercicio de fuerza-resistencia como terapia complementaria para el enfermo de cáncer de próstata mejora la calidad de vida del hombre mayor disminuyendo la situación descondicionamiento físico y psicosocial (Culos-Reed et al., 2007; Segal et al., 2003). La mayoría de programas revisados se basan en la guía general que recomienda la American College Sports Medicine Position Stand para la promoción del ejercicio en personas mayores sanas (ACSM, 1998). Los programas vigentes no consiguen adaptarse específicamente a las personas enfermas de cáncer de próstata, resultando excesivamente genéricos, incompletos y poco flexibles (Serdà, 2009). Para conseguir una mayor eficacia el programa general ha de transformarse en relación a los síntomas, necesidades especiales derivadas de la enfermedad, sus tratamientos y la comorbididad del hombre mayor (Courneya, 2001). La efectividad del programa de ejercicio está supeditada a la gestión y el control de las variables que determinan las características de la actividad.
La consideración de estos aspectos, facilita la compatibilidad del programa de fuerza-resistencia con el cáncer de próstata y su promoción para paliar el descondicionamiento e incapacidad que genera la enfermedad y el tratamiento (Serdà et al., 2009). A partir de un programa de estas características se observaría una mayor eficacia en el aumento de la capacidad de fuerza-resistencia muscular y su transferencia en la calidad de los patrones motores básicos (Latham et al., 2003; Latham et al., 2004). Esta mejora disminuiría la fatiga, el proceso de osteopenia y osteoporosis provocados por la asociación de los factores de edad, tratamiento hormonal e inactividad. Además disminuiría el riesgo del encadenamiento de caída-fractura-dependencia (Bliuc et al., 2009) consiguiendo mejorar la calidad de vida y la supervivencia del hombre mayor con cáncer de próstata (Higano, 2003).
Este artículo se plantea mostrar dos objetivos:
1. El diseño de un programa de ejercicio progresivo de fuerza-resistencia adaptado al paciente con cáncer de próstata considerando las variables significativas de los estudios destinados a personas mayores sanas (≥ 65 años) o enfermas de patología no cancerígena.
2. El cambio intrasujeto de las variables físicas, funcionales y de la calidad de vida conseguido después de 24 semanas del programa.
MATERIAL Y MÉTODOS
Localidad y participantes
Tras obtener el informe favorable del comité ético de investigación, el programa de ejercicio se realizó en el Hospital de Figueres (España), desde el mes de octubre de 2006 al mes de octubre de 2007.
Para la inclusión de los sujetos en el programa es necesario que cumplieran tres condiciones:
1. Se requiere el diagnóstico histológico de cáncer de próstata, en cualquier estadio de la patología en fase de tratamiento.
2. Haber superado el examen médico preinterventivo en el que declara que el enfermo no presenta ninguna de las contraindicaciones incompatibles con el programa de ejercicio.
3. Firmar el consentimiento informado del interesado.
Los criterios de exclusión son la presencia de cualquier patología que contraindique la práctica temporal o permanente del ejercicio físico, destacando como contradicciones absolutas, los grupo III y IV enfermedad cardiaca según la clasificación de la New York Heart Association, la hipertensión arterial descontrolada, dolor secundario a metástasis ósea, enfermedad psiquiátrica y la imposibilidad de entender o hablar el español.
Aleatoriedad en la selección de la muestra
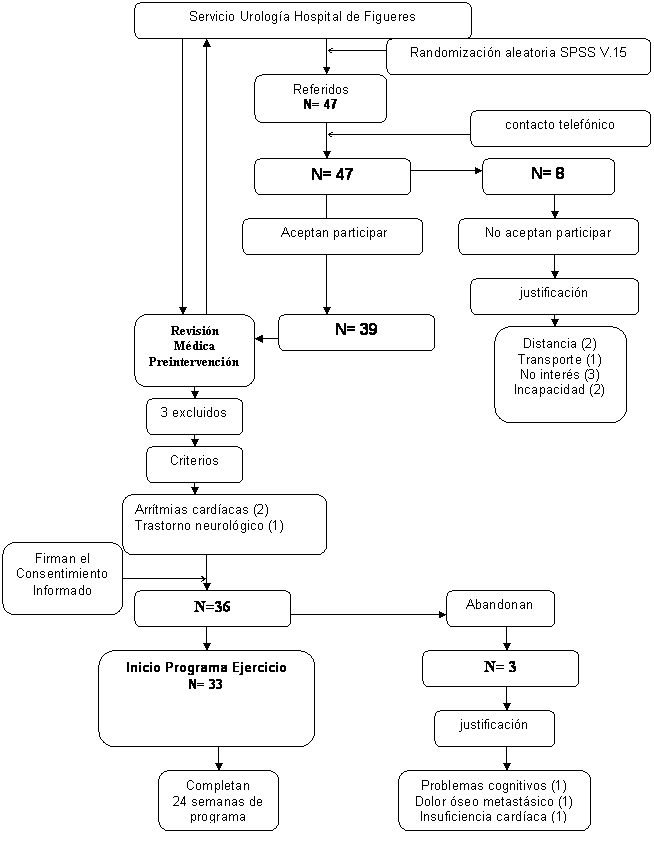
El diseño del estudio es cuasiexperimental. Inicialmente se seleccionan 47 sujetos de forma aleatoria a partir de 205 registros de historia clínica referidos por el Servicio de Urología del Hospital de Figueres. Se utilizó el programa SPSS v.15 aplicando la función random selection. De los 47 sujetos, 8 decidieron no participar en el estudio por vivir a gran distancia del Hospital y no disponer de transporte, falta de interés e incapacidad física. De los 39 sujetos restantes, 3 fueron excluidos por razones médicas, arritmias cardíacas y trastorno neurológico. De los 36 participantes que iniciaron el programa 3 abandonaron por problemas cognitivos, dolor óseo metastásico e insuficiencia cardiaca. La muestra final la formaron 33 participantes. El diagrama de flujo CONSORT representa el procedimiento de la muestra en el estudio (ver figura 1). La asistencia a las sesiones fue superior al 93% (30 de 32 sesiones).
Figura 1. Diagrama de flujo CONSORT
INTERVENCIÓN PROGRAMA DE EJERCICIO
Las características del programa progresivo de fuerza-resistencia son:
– La duración de 24 semanas. 16 semanas de control directo a indirecto del profesional de educación física y 8 semanas de trabajo autónomo.
– La frecuencia de trabajo es de 2 sesiones semanales de 90 minutos, en las cuales se incluyen 1 o 2 series de 8 a 12 repeticiones de 10 ejercicios correlativos.
– Los ejercicios corresponden al trabajo de la musculatura de: cuadriceps, pectoral, isquiotibiales, deltoides, abdominales (hipopresivos), bíceps, tríceps, 2 dorsales y musculatura del suelo pélvico. El trabajo del suelo pélvico incluye tres niveles, primero, la conciencia y el control de la musculatura, segundo, el refuerzo de la musculatura profunda del suelo pélvico y tercero, el desbordamiento de energía desde la musculatura sana distante a la zona muscular del suelo pélvico debilitada.
– La intensidad de trabajo es del 50% al 70% del 8 RM previamente calculado con el test de Lander (Lander, 1985). Es estrictamente obligatorio no sobrepasar el umbral del 70% del 8 RM para evitar el riesgo de secreción de testosterona (Fleck y Kraemer, 2003). Además se considera la percepción individual de la intensidad del esfuerzo controlado a partir de la escala modificada de percepción subjetiva del esfuerzo de Borg CR-10 (Borg, 1990).
– La progresión ascendente se rige con el incremento consecutivo de repeticiones, series y peso. Al sobrepasar las 12 repeticiones en la segunda serie se puede aumentar el peso, siempre y cuando el incremento de peso semanal no sobrepase el 10% del 8 RM.
– La adherencia al programa se potenció siguiendo un diseño del modelo de adherencia (Serdà, 2009) construido a partir de los principales modelos vigentes. El modelo incluye una estrategia didáctica por fases, que fomenta la autonomía progresivamente, traspasando el control de la actividad del supervisor al participante. El apoyo contingente durante el programa permite reforzar las variables más debilitadas. Se destacan, la percepción de control, la autoeficacia, la identificación de la dosis terapéutica y la satisfacción que provoca.
Tabla 1. Característiques del programa setmanal de Fuerza-Resistencia muscular
|
Semanas |
Fase |
Series |
Repeticiones |
Intensidad % 8 RM |
Esfuerzo* |
|
1 |
Base |
1 |
8-12 |
50% |
6-7 |
|
2 |
Inicial |
1 |
8-12 |
60% |
6-7 |
|
3 |
Inicial |
1 |
8-12 |
60% |
6-7 |
|
4 |
Inicial |
2 |
8-12 |
60% |
6-7 |
|
5 |
Progresión |
2 |
8-12 |
60% |
6-7 |
|
6 |
Progresión |
2 |
8-12 |
60% |
6-7 |
|
7 |
Progresión |
2 |
8-12 |
60% |
6-7 |
|
8 |
Progresión |
2 |
8-12 |
70% |
6-7 |
|
9 |
Progresión |
2 |
8-12 |
70% |
6-7 |
|
10 |
Progresión |
2 |
8-12 |
70% |
6-7 |
|
11 |
Supervisado |
2 |
8-12 |
70% |
6-7 |
|
12 |
Supervisado |
2 |
8-12 |
70% |
6-7 |
|
13 |
Supervisado |
2 |
8-12 |
70% |
6-7 |
|
14 |
Autónomo |
2 |
8-12 |
70% |
6-7 |
|
15 |
Autónomo |
2 |
8-12 |
70% |
6-7 |
|
16-24 |
Autónomo |
2 |
8-12 |
70% |
6-7 |
Abreviaturas: * Percepción de esfuerzo (basado en la escala de Borg)
VARIABLES ESTUDIADAS
Para evaluar el cambio intrasujeto se tomaron medidas pre-test (semana 0) y post-test (semana 24).
En la evaluación pre-test se tuvo en cuenta la información sobre la experiencia de la enfermedad incluida en la anamnesis, estadio de la enfermedad según la técnica TNM, el tipo de tratamiento (quirúrgico, hormonal o combinado), el hábito previo al ejercicio físico a partir del cuestionario de Godin (Godin y Shephard, 1985), el cuestionario de toxicidad del tratamiento y los datos del cuestionario sociodemográfrico. Con la anamnesis se concretan los síntomas secundarios relativos a la enfermedad y el tratamiento. Éstos se triangulan con los síntomas registrados en la historia clínica. El diseño del programa de fuerza permite adaptarse de forma flexible a los síntomas derivados de la enfermedad y sus tratamientos.
Las variables evaluadas pre/post test fueron las siguientes:
– Las variables antropométricas han seguido el protocolo (AAPHERD, 1988) y corresponden al peso, el índice de masa corporal, el índice cintura cadera, el perímetro cintura, la suma de los siete pliegues cutáneos incluyendo (pectoral, axilar medio, tricipital, subescapular, abdominal, suprailíaco y muslo) y el porcentaje de masa grasa es estimada a partir de la fórmula de Jackson y Pollock (Jackson y Pollock, 1978). El tejido graso visceral abdominal se evaluó con el CT-escáner.
– La bioquímica completa procesada en el laboratorio central, evaluó los niveles de testosterona libre en sangre, lípidos en sangre incluyendo (colesterol total, lipoproteínas de alta y baja densidad en colesterol y triglicéridos) y los niveles de Antígeno Prostático Específico (PSA).
– La capacidad de fuerza-resistencia se estimó a partir del número total de contracciones musculares completadas a una cadencia de 22 repeticiones/minuto marcadas por un metrónomo (metrónomo de Korg MA-30) programado a 44 pulsaciones/minuto con una carga liviana.
– La fuerza submáxima muscular, se evaluó a partir del máximo peso que el participante pudo levantar en 8 repeticiones consecutivas manteniendo una posición higiénica sin descompensarse, siguiendo el protocolo de la ASEP (Brown y Weir, 2001). La carga a movilizar correspondió al 70% de la 8 RM estimada con los resultados del test de fuerza-resistencia aplicando la fórmula de Lander (Jiménez, 2008). Este valor permite calibrar la intensidad de trabajo a nivel individual de acuerdo a los porcentajes programados. El test incluye la evaluación de dos grupos musculares, uno localizado al tronco implicando la musculatura de pectoral y se realiza en el banco horizontal. El otro localizado en la extremidad inferior implicando la musculatura de muslo y pierna y se realiza en la prensa de pierna.
– El esfuerzo submáximo se valoró a partir de la prueba del escalón correspondiente al Test de fitness canadiense modificado (mCAFT) (Weller et al., 1995) controlado con la frecuencia, la tensión arterial y la percepción subjetiva del esfuerzo con la escala de Borg CR-10.
– La tensión arterial se midió según el procedimiento que especifica la guía de práctica clínica y material docente de la hipertensión arterial del Institut Català de la Salut (Amado Guirado 2003).
– La intensidad del síntoma de incontinencia se evaluó con la escala visual analógica categórica que incluye 4 categorías desde 0, no mojado hasta 10, totalmente mojado.
– La intensidad del dolor se evaluó a partir de la escala visual analógica numérica. La puntuación está numerada desde 0, no dolor hasta 10, dolor insoportable.
– La fatiga se evaluó con el cuestionario FACIT-escala de cansancio (4ª versión). [Rango: 0-52]
– La calidad de vida se evaluó mediante el cuestionario FACT-P, Functional Assessment Cancer Therapy Scale- Prostate [Rango: 0-156] (4ª versión) (Esper et al., 1997).
Además, durante la ejecución del programa se realizó una observación global estructurada en relación a la ejecución técnica del programa. Para la observación se utilizó una escala Likert de 4 puntos e incluyó los aspectos de la postura, la biomecánica de contracción, la función respiratoria, los patrones motores de la marcha y el escalón [Rango: 0-30]. La observación garantiza la salud del participante disminuyendo el riesgo de lesión que conlleva el trabajo. Se realiza una observación semanal registrada por el experimentador y una cámara de video.
El momento post-test se evaluó, además de las variables mencionadas anteriormente, la adherencia al programa. La variable de adherencia se avaluó teniendo en cuenta el hábito previo al ejercicio físico a partir del cuestionario de Godin (Godin y Shephard, 1985) y la práctica autónoma de los ejercicios del programa 8 semanas después de la finalización del mismo incluyendo las variables del modelo integrado de adherencia (Serdà, 2009).
CÁLCULO DEL TAMAÑO DE LA MUESTRA Y ANÁLISIS ESTADÍSTICO
El tamaño de la muestra calculada para detectar una diferencia entre grupos de 5,0 puntos es el resultado el test FACT-P (desviación estándar DE:9). Se aplica el test de dos colas con un riesgo alfa del 5% y un riesgo beta del .05. El número necesario de participantes es de 33. Para los datos apareados en las variables continuas que siguen una distribución normal, el test estadístico utilizado es la t de Student-Fisher con un número de grados de libertad de (n-1). Para las variables continuas que no siguen una distribución normal se utiliza el test no paramétrico para datos apareados de Wicolxon o U de Man Whitney. Para analizar las variables categóricas se utiliza el test del X2. Se ha diseñado un modelo multivariante con las dimensiones que integran el cuestionario de Calidad de Vida. Se han estudiado las variables del modelo multivariante que resultan significativas y explican la variación del test de calidad de vida a partir del análisis de regresión lineal múltiple. Los análisis estadísticos se realizan con el programa SPSS versión 15. El nivel de significación escogido es del 5%.
RESULTADOS
La descripción de las características clínicas y epidemiológicas de los participantes se detalla en la tabla 2.
Tabla 2. Línea base de los participantes en el estudio
|
Variable |
Grupo intervención (n=33) |
|
Edad (años)
|
71,78 (7,22) [55- 83] |
|
Peso (Kg)
|
80,40 (11,60) [64,2 – 111,5]. |
|
IMC (Kg/m2)
|
28,67 (2,99) [24,16 a 33,97 ] |
|
Tensión Arterial (mm Hg) PAS PAD |
150,25 (21,31) 81,90 (11,03) |
|
Frecuencia cardiaca reposo (latidos/ minuto)
|
74 (10,74) |
|
Clasificación tumoral TNM Nº (%) Estadio I Estadio II Estadio III Estadio IV Desconocido |
0 (0) 13 (39,39) 18 (54,54) 1 (3,03) 1 (3,03) |
|
PSA diagnóstico (ng/mL)
|
17,95 (24,32) [2,84 – >100] |
|
PSA inicio del programa (ng/mL)
|
0’55 (1,36) [0,01- 5,5]. |
|
Tratamiento Nº (%) Quirúrgico (P) Hormonal (TDA) Combinado R + TDA P + TDA |
15 (45,45) 15 (45,45)
1 (3,03) 2 (6,06) |
|
Cuestionario sociodemográfico Estado civil Casado/s Viudo/s Soltero/s Situación laboral Jubilado/s Activos/s |
30 (90,90) 2 (6,06) 1 (3,03)
31 (93,93) 2 (6,06) |
|
Ejercicio aeróbico previo Nº (%) Cat 1 ≥ 3 veces por semana Intenso Moderado Suave Cat 2 < 2 veces por semana Intenso Moderado Suave |
24 participantes, (72,72%) 1 participante, (3,03 %) 11 participantes, (33,33%) 12 participantes, (36,36%) 9 participantes (27,27)
5 participantes, (15,15%) 4 participantes, (12,12%) |
|
Ejercicio de fuerza-resistencia previo Nº (%) ≥ 3 veces por semana < 2 veces por semana |
0 (0) 0 (0) 0 (0) |
Abreviaturas: IMC, índice de masa corporal; PAS, presión arterial sistólica; PAD, presión arterial diastólica; PSA, antígeno prostático específico; P, prostatectomía; TDA, Terapia de privación androgénica; R + TDA, radioterapia combinada con terapia de privación androgénica; P+TDA, prostatectomía con terapia de privación androgénica.
Los resultados de las variables antropométricas determinan que el perfil del participante es androide con una concentración de grasa a nivel abdominal. Al finalizar el programa se observa una disminución significativa en las medias y desviación típica (Dt) de todas las variables excepto la del peso (ver tabla 3). Se registra una disminución significativa en cada uno de los siete pliegues corporales, de todos ellos, los 2 pliegues que proporcionalmente disminuyen más se circunscriben en el área abdominal y corresponden concretamente al pliegue suprailiaco, con una diferencia de la media de 6,22 (Dt 5,29; P≤,001) y el pliegue abdominal con una diferencia de la media 5,91 (Dt 9,42; P≤,001) Mientras que, el pliegue que disminuye menos corresponde al pliegue pectoral 4,75 (Dt 5,29.;P≤,001).
Tabla 3. Descripción antropométrica
|
Variables |
(n) |
Pretest |
Postest |
Pretest- Postest‡ |
||||
|
|
Dt |
|
Dt |
|
Dt |
p* |
||
|
Peso (Kg) |
33 |
80,40 |
11,60 |
79,92 |
12,08 |
0,478 |
1,89 |
,157 |
|
IMC (Kg/m2) |
33 |
28,67 |
2,99 |
28,20 |
3,06 |
0,46 |
1,02 |
,007* |
|
ICC |
33 |
1,01 |
0,05 |
0,99 |
0,05 |
0,02 |
0,03 |
,003* |
|
PC |
33 |
104,46 |
8,68 |
101,90 |
8,97 |
2,56 |
2,49 |
≤,001* |
|
∑7 pliegues (mm) |
33 |
219,76 |
44,17 |
180,30 |
37,10 |
39,46 |
31,09 |
≤,001* |
|
MG-7 (%) |
33 |
40,87 |
15,18 |
28,96 |
11,42 |
11,90 |
10,59 |
≤,001 |
Abreviaturas: IMC, Índice de Masa Corporal; ICC, Índice Cintura cadera; PC, perímetro cintura; ∑7 pliegues, Suma de los siete pliegues corporales; MG-7 (%), Masa de Grasa expresado en porcentaje.
En relación a los parámetros cardiovasculares de reposo y de esfuerzo se observa una disminución significativa de todas las variables excepto la presión arterial diastólica tanto de reposo como de esfuerzo submáximo (Ver tabla 4).
Tabla 4. Frecuencia cardíaca y presión arterial de reposo
|
Variables |
(n) |
Pretest |
Postest |
Pretest-Postest ‡ |
||||
|
|
Dt |
|
Dt |
|
Dt |
P* |
||
|
FC-R |
33 |
74,00 |
10,74 |
71,96 |
11,59 |
2,03 |
8,79 |
,02* |
|
PAS-R |
33 |
150,25 |
21,31 |
139,96 |
18,65 |
10,28 |
16,16 |
<,001* |
|
PAD-R |
33 |
81,90 |
11,03 |
78,65 |
10,28 |
3,25 |
11,61 |
,062 |
|
FCsubmáx |
24 |
122,83 |
16,98 |
115,58 |
19,51 |
7,25 |
19,42 |
,040* |
|
PASsubmáx |
24 |
180,58 |
22,29 |
172,79 |
25,81 |
7,79 |
20,66 |
,039* |
|
PADsubmáx |
24 |
90,16 |
14,96 |
83 |
9,95 |
7,16 |
16,88 |
,049 |
|
Borgsubmáx |
24 |
5,08 |
1,742 |
4,375 |
1,61 |
,70 |
1,6 |
,02* |
|
VO2 màx |
30 |
16,16 |
8,04 |
22,26 |
5,73 |
6,10 |
5,07 |
<,001* |
Abreviaturas: ‡: Cambios observados a las 24 semanas del programa de intervención; FCR: Frecuencia cardiaca de reposo (latidos/min); PAS-R: Presión arterial sistólica de reposo (mmHg); PAD-R: Presión arterial diastólica de reposo (mmHg).FCsubmáx: frecuencia cardiaca submáxima (latidos/min); PASsubmáx: presión arterial sistólica submáxima (mmHg); PADsubmáx: presión arterial diastólica submàxima (mmHg) Borgsubmáx: Escala de percepción subjetiva del esfuerzo de Borg submáximo; VO2 máx: consumo máximo de oxígeno [ml kg-1 min -1];
Los cambios en la resistencia muscular y la fuerza submáxima (8 RM) se incluyen en la tabla 5. El porcentaje de aumento de las variables tanto de la resistencia muscular como la 8 RM es superior en las extremidades inferiores que las superiores. En el grupo de pectoral, la fuerza- resistencia aumenta en un 57,83% mientras que la 8RM aumenta el 22,76%. En la musculatura de la extremidad inferior la fuerza- resistencia aumenta en un 61,45 % mientras que la 8RM aumenta el 45,49%.
Tabla 5. Fuerza muscular
|
Descripción del parámetro |
Pretest |
Postest |
Pretest-Postest ‡ |
||||||||
|
Variables |
Grupo |
Rango |
(n) |
|
Dt |
|
Dt |
|
Dt |
p* |
|
|
Pretest |
Postest |
||||||||||
|
Rmusc |
Pec |
[2-23] |
[7-42] |
31 |
12,83 |
5,20 |
20,25 |
7,87 |
7,41 |
6,97 |
<,001* |
|
EI |
[8-50] |
[10-90] |
32 |
19,43 |
9,49 |
31,37 |
18,12 |
11,93 |
18,87 |
<,001* |
|
|
8 RM |
Pec |
[5,3-36,5] |
[6,6-45,6] |
32 |
21,66 |
8,38 |
26,59 |
8,91 |
4,93 |
4,37 |
<,001* |
|
EI |
[6,6-135,4] |
[10,7-159,6] |
32 |
57,59 |
35,19 |
83,79 |
43,33 |
26,19 |
24,78 |
<,001* |
|
Abreviaturas: Rmusc: resistencia muscular; 8 RM: fuerza submáxima, calculada mediante las fórmulas de Lander, J. (1) (Lander, 1985); Pec: pectoral; EI: extremidades inferiores; ; ‡: Cambios observados a las 24 semanas del programa de intervención; p* Valor de significación p ‹ ,05.
Se observa una mejora significativa de la fuerza-resistencia muscular y la fuerza submáxima. El efecto es mayor en las extremidades inferiores (Ver tabla 7). Fórmula de Lander (1985): Carga levantada (Kg) / [1,013 -0,0267123 NR ].
La media de la variable FACT-P aumenta de forma significativa al finalizar el programa de ejercicio físico (ver tabla 6).
En relación a los síntomas relativos a la enfermedad, con el programa se observa una disminución significativa de los síntomas de incontinencia y dolor, mientras que la mejora de la fatiga no es significativa (ver tabla 6).
Tabla 6. Cambios en las medias y desviación típica de la incontinencia urinaria, la fatiga y el dolor.
|
Descripción del parámetro |
Pretest |
Postest |
Diferencias relacionadas‡ |
||||||
|
Cuestionario |
Rango |
(n) |
|
Dt |
|
Dt |
|
Dt |
p* |
|
EVA-IU |
[0-10] |
33 |
3,79 |
2,54 |
1,03 |
.918 |
2,75 |
1,88 |
,000* |
|
FACIT |
[0-52] |
33 |
39,91 |
9,72 |
42,90 |
6,60 |
2,99 |
10,46 |
,110 |
|
EVA- D |
[0-10] |
33 |
4,57 |
2,41 |
2,66 |
1,79 |
1,90 |
1,25 |
≤,001 |
Abreviaturas: EVA- IU: escala visual analógica de la incontinencia urinaria; FACIT: cuestionario de fatiga; EVA-D: escala visual analógica del dolor;![]() : media; Dt: desviación típica; ‡: cambios observados a las 24 semanas de programa de intervención. p*: valor de significación P ‹ ,05.
: media; Dt: desviación típica; ‡: cambios observados a las 24 semanas de programa de intervención. p*: valor de significación P ‹ ,05.
Cuando analizamos los resultados del cuestionario de calidad de vida (FACT-P) pre/post-test observamos un aumento significativo en la media de 9,39 puntos (Dt de 16,55; p ,003* ). Para explorar la relación existente entre el síntoma de IU y la mejora de la Calidad de vida en los enfermos, se categorizó la variable de la escala visual analógica categórica de la IU en dos grupos, correspondiente a 1, menos mejora en la incontinencia urinaria y 2, más mejora en la incontinencia urinaria. Se comparó el resultado del cuestionario de CdV (FACT-P) antes y después del programa con la variable mejora de la incontinencia urinaria. La media del cuestionario FACT-P en el grupo con más mejora de la incontinencia urinaria (![]() =14,75) es superior estadísticamente a la media (
=14,75) es superior estadísticamente a la media (![]() =2,95) de los pacientes que tienen menos mejora de la IU (t de student = 2,15; p=,039).
=2,95) de los pacientes que tienen menos mejora de la IU (t de student = 2,15; p=,039).
Considerando el modelo multivariante de las dimensiones que integran el cuestionario de la calidad de vida FACT-P. Se realizó la regresión lineal múltiple con el objetivo de analizar las diferencias obtenidas entre el valor post-intervención y el valor pre-intervención, tanto en el valor total del test de calidad de vida como de cada una de las dimensiones. Además, se consideró el coeficiente ß de cada variable independiente con el objetivo de interpretar el signo de forma que, si es positivo aumenta el valor de la variable y si es negativo disminuye. Las variables del modelo multivariante que resultan significativas y explican la variación en la puntuación del test de CdV son: El estado físico general de salud, el estado emocional y la dimensión de los síntomas relativos al cáncer de próstata. Las dimensiones no significativas son el ambiente familiar y social y la escala de fatiga. La R2 = ,933%. (Ver tabla 7). Manteniendo las variables significativas del modelo conseguimos los nuevos coeficientes que se muestran en la tabla 8.
Tabla 7. Dimensiones cuestionario FACT
|
|
T |
ß |
P* |
|
1.- PWB: estado físico general de salud. |
2,528 |
,249 |
,018 |
|
2.- SWB: ambiente familiar y social. |
1,170 |
,122 |
,252 |
|
3.- EWB: estado emocional. |
3,769 |
,404 |
,001 |
|
4.- PCS: otras preocupaciones. |
3,909 |
,365 |
.001 |
|
5.- FACIT: escala de fatiga. |
-3,19 |
-,028 |
,752 |
|
R2 =,933% |
|
|
|
Tabla 8. Dimensiones cuestionario FACT-P
|
|
T |
ß |
P* |
|
1.- PWB: estado físico general de salud. |
3,32 |
,285 |
,002 |
|
3.- EWB: estado emocional. |
4,54 |
,419 |
,000 |
|
4.- PCS: Síntomas. |
4,56 |
,404 |
.000 |
PCS: en el cuestionario de Calidad de vida corresponde a Otras preocupaciones, atribuido a los síntomas relativos a la enfermedad y al tratamiento.
Al evaluar la adherencia de los participantes al programa utilizando el modelo integrado se constató un 100% de adherencia a la actividad en la semana 24. Los participantes informaron que el mantenimiento de la conducta autónoma de ejercicio estaba mediado por la percepción de mejora en el síntoma de incontinencia y el dolor, además del bienestar general post-entrenamiento. Las variables de percepción de control, autoeficacia, el conocimiento de la dosis terapéutica, la distracción psicosocial y la fuerza de voluntad se identificaron como decisivas para el mantenimiento de la conducta a largo término.
Los resultados derivados de la unidad de observación global estructurada mostraron que len la fase inicial (semanas 1-6) la puntuación media fue de 12,5 puntos, mientras que el resultado de la fase autónoma (semanas 18-24) fue de 24 puntos. Destacamos la mejora en la calidad de los patrones motores básicos, destacando la coordinación en el ascenso y descenso del escalón en el test aeróbico submáximo mCAFT.
DISCUSIÓN
La descompensación antropométrica, metabólica y cardiovascular es habitual entre los hombres de cáncer de próstata. Este efecto está provocado por el déficit de secreción de testosterona (Traish et al., 2009b). El fenotipo pretest del participante corresponde a la tipología II (androide). El exceso de grasa en la zona abdominal se identifica a partir de las variables del perímetro cintura, el índice cintura cadera y la muestra de los dos pliegues de mayor espesor, el suprailíaco y abdominal. El depósito graso intrabdominal correlaciona directamente con los factores de riesgo cardiovascular. Si esta situación se mantiene y no revierte es un factor de riesgo de morbimortalidad (Martínez-Hervas, 2008). Los resultados de este estudio concuerdan con la actualización de la ACSM (2009), en que el ejercicio de fuerza-resistencia es una forma eficaz para mejorar la calidad de los tejidos. Los resultados confirman la disminución significativa de las variables antropométricas del IMC, el perímetro cintura, el índice cintura cadera, la suma de los siete pliegues cutáneos y el porcentaje de masa grasa.
La mejora de la eficacia cardiovascular se detecta a partir de la disminución de las variables: frecuencia cardiaca, tensión arterial, percepción subjetiva del esfuerzo tanto en situación de reposo como en esfuerzo submáximo. En el postest mejora la capacidad de trabajar a una intensidad de esfuerzo mayor con una recuperación cardiovascular postesfuerzo más eficaz. Se registra un descenso gradual de la tensión arterial que es evidente y significativo a partir de la sexta semana del programa. Al finalizar la fase experimental el subgrupo de personas hipertensas se reduce el 50% mediado por el descenso de la presión arterial sistólica. De acuerdo con los resultados se confirma que el programa tiene un efecto hipotensor significativo en la presión arterial sistólica del subgrupo de hombres hipertensos aunque no podemos confirmar que el efecto se mantenga a largo término. La mejora registrada en la respuesta cardiovascular del enfermo de cáncer de próstata corrobora el principio de relación entre capacidades. En este sentido, la mejora en la capacidad de fuerza detectada con las variables fuerza-resistencia y fuerza-submáxima generan la adaptación en la capacidad aeróbica registrada con las variables de eficacia cardiovascular en estado de reposo y en situación de esfuerzo submáximo mCAFT. El comportamiento de las variables evidencia una disminución del estrés cardiovascular con un mayor trabajo resultante y una menor percepción subjetiva del esfuerzo. Se deben realizar más estudios en esta línea para cuantificar la relación entre la dosis exacta de actividad de fuerza y su efecto en la salud cardiovascular.
La mejora del perfil antropométrico y de la respuesta cardiovascular descrita es determinante en la mejora de los factores interrelacionados con el síndrome metabólico. Este efecto se identifica con el análisis conjunto derivado de la disminución de las variables del perfil de lípidos en sangre, tensión arterial de reposo y en actividad, reducción de la obesidad abdominal y mejora de la glucemia, lo que implica una mayor sensibilidad a la insulina (Dunstan et al., 2002). Estos resultados coinciden con los de Warburton y confirman la mejora del síndrome metabólico correlaciona con la mejora de la dimensión funcional y la CdV de la persona mayor (Warburton et al., 2001).
La mejora registrada en las variables de fuerza submáxima y fuerza-resistencia es ineludible. De acuerdo con Liu y Latham (Liu y Latham, 2009) observamos que el aumento de fuerza tiene un efecto de retroacción positiva, de forma que revierte y transfiere en la capacidad, la ejecución técnica y la calidad de los patrones motores básicos de la marcha y el ascenso-descenso del escalón. Este resultado se confirma tanto con el análisis de los cambios identificados en los registros periódicos de la unidad de observación global estructurada como en los resultados del test submáximo aeróbico mCAFT.
La mejora registrada en fuerza-resistencia es superior a la fuerza-submáxima. En ambas variables, el incremento es superior en las extremidades inferiores que en el tronco (Segal 2009). Se ha de considerar que la pérdida fisiológica natural de fuerza en las personas mayores es anterior en las extremidades inferiores a la pérdida en las extremidades superiores. Además, el aumento de la fuerza extensora de las extremidades inferiores correlaciona con el aumento de la velocidad de la marcha, capacidad de propiocepción y reequilibrio (Tinetti y Williams, 1998). Este efecto reduce el riesgo de caída y fractura. A nivel general mejora la CdV de la persona mayor (Buchner, 1997).
El resultado de incremento de la capacidad de fuerza correlaciona con el freno del proceso catabólico del sistema muscular, mejora el estado de sarcopenia que se agrava y perpetúa con la enfermedad del cáncer. La recuperación tanto de la masa muscular como la intensidad y calidad de contracción muscular genera un arco de movimiento eficaz. Estos factores concretos determinan la mejora general de la funcionalidad, en la habilidad y en el movimiento que exigen las actividades de la vida diaria, retardando la manifestación de fatiga y mejorando la salud percibida de las personas mayores (Salem et al., 2000; Warburton et al., 2001; Ringsberg et al., 1999).
Los resultados de los estudios describen una relación directamente proporcional entre el trabajo de fuerza muscular y la densidad mineral ósea. Este efecto también se identifica en personas mayores, aunque la magnitud del cambio depende del estado inicial de la estructura (Warburton et al., 2001).
En contrapartida, el trabajo de fuerza en personas mayores tiene un mayor riesgo de sufrir lesiones de las partes blandas, principalmente en las inserciones tendinosas (Kolt et al., 2004). Este riesgo aumenta en el subgrupo de personas enfermas. Este factor justifica la importancia de calibrar la dosis de trabajo eficaz para conseguir el máximo beneficio en la estructura ósea y muscular, minimizando el riesgo de lesión (Gregg et al., 2000). Los estudios revisados estiman que la duración mínima del programa de fuerza para conseguir el aumento de la densidad mineral ósea es de 24 semanas (Wolff et al., 1999). La gestión de este parámetro concuerda con el diseño de nuestro programa, superando una de las limitaciones metodológicas identificadas en otros programas similares (Segal et al., 2003). Los resultados observados justifican el efecto del trabajo de fuerza sobre la salud ósea, aunque no se debe olvidar la promoción de la correcta alimentación con ingesta de calcio. (Evans, 1998). La disminución de la capacidad músculo-esquelética y sobretodo en las extremidades inferiores correlaciona con la tríada caída, fractura y dependencia de la persona mayor. Este riesgo aumenta enormemente en la persona frágil (Fiatarone et al., 1993; Tinetti y Williams, 1998). El impacto resultante de la caída sobre el hueso osteoporótico, habitualmente causa una fractura, con la consecuente pérdida de movilidad y con el riesgo de generar el síndrome post-caída como consecuencia una situación de dependencia funcional (Buchner et al., 1997).
La mejora osteomuscular permite a la persona mayor mantener la autonomía retardando el riesgo de situarse en la zona umbral de dependencia que habitualmente provoca la enfermedad y el tratamiento de cáncer. A partir del entrenamiento de fuerza programado, se observa un efecto inicial de condicionamiento muscular y posteriormente un aumento de la salud ósea. Una mejora del estado de salud osteomuscular retarda el riesgo de entrar en la zona umbral de de dependencia habitual en las personas mayores tratadas de cáncer (Kamel et al., 2003; Kamel, 2003; Suh y Lyles, 2003).
Además, el programa consigue disminuir, controlar y revertir los síntomas de incontinencia, fatiga y dolor. El efecto se consigue por la capacidad que ofrece el programa de adaptación flexible a los síntomas más habituales asociados a la enfermedad y sus tratamientos. Por ejemplo, considerando el síntoma de incontinencia, el programa de fuerza incluye la gestión de tres fases consecutivas correspondientes a la sensopercepción del suelo pélvico, el reforzamiento y finalmente los ejercicios de desbordamiento irradiados desde la musculatura sana hacia la musculatura atrofiada y dañada del suelo pélvico. Este modelo organizado por fases y adaptado al síntoma de incontinencia consigue mejorar de forma significativa la CdV del subgrupo de participantes afectados de incontinencia urinaria con un resultado mayor comparado con el subgrupo de enfermos no afectados o con los resultados de programas similares que no tienen la capacidad de adaptarse a los síntomas (Palmer et al., 2003;Culos-Reed et al., 2007). Los mecanismos concretos que median la mejora son los de conciencia y el control de la continencia. Este efecto podría incidir en la mejora del resto de dimensiones que integran el cuestionario de Calidad de Vida, por ejemplo la recuperación de la red social.
La American Society of Clinical Oncology (2008), confirma que la CdV, es un indicador fuerte e independiente de la supervivencia en el cáncer. En este estudio, el comportamiento de las dimensiones que integran el cuestionario de CdV y mejoran de forma significativa son la capacidad de funcionamiento personal, el bienestar emocional y la dimensión que incluye los síntomas relativos a la enfermedad (incontinencia, dolor y fatiga).
Desde la fase inicial del programa se ha realizado el estudio contextualizado para la promoción multidisciplinar de las variables que correlacionan con la adherencia. La piedra angular del estudio son las personas mayores afectadas de cáncer de próstata y su entorno sociofamiliar. Desde esta perspectiva, se entiende a la adherencia como un proceso y no como un valor final del estudio. Por este motivo en la fase experimental se ha ofrecido el apoyo contingente requerido en relación a las variables más débiles relativas a la percepción de control, la autoeficacia, la percepción de mejora, el conocimiento de la dosis terapéutica. Esta consideración ha favorecido el mantenimiento autónomo de la actividad una vez finalizada la fase experimental, consiguiendo una adherencia del 100% de la muestra.
Los resultados reafirman la controversia sobre la eficacia del screening y diagnóstico del cáncer de próstata a partir del test del PSA en el cribaje poblacional (Schroder et al., 2009; Andriole et al., 2009). También nos planteamos la cuestión sobre la necesidad de tratamiento del cáncer de próstata de bajo riesgo. Esta afirmación se justifica por el encadenamiento de factores riesgo observados de forma conjunta o secuencial que determinan el síndrome metabólico del hombre mayor tratado de cáncer de próstata. En este estudio identificamos el perfil graso, la hipertensión arterial (con hipertensión sistólica aislada), la frecuencia cardiaca de reposo elevada, el colesterol, el valor elevado de lipoproteínas de alta densidad, la dieta excesiva en grasas saturadas y la conducta sedentaria. La combinación de estos factores eleva el riesgo de enfermedad cardiovascular (Traish et al., 2009a). Si a este perfil además le añadimos los efectos secundarios propios de la enfermedad y sus tratamientos como, la incontinencia urinaria, disfunción e impotencia sexual, la fatiga, el distrés, aislamiento social…etc determina que el impacto del tratamiento del cáncer de próstata en la Calidad de Vida del enfermo es superior al que generaría la enfermedad. Concluimos el apartado con la cita de Traish, la identificación de estos factores confirma la cara oscura, silenciosa y desconocida del tratamiento de privación androgénica (Traish et al., 2009a; Traish et al., 2009b).
CONCLUSIONES
– A partir del programa de fuerza programado mejora la capacidad de fuerza-resistencia y la fuerza submáxima. La mejora general de la fuerza es superior en las extremidades inferiores que en el tronco. Se observa una transferencia de la fuerza en la capacidad aeróbica y en la habilidad de los patrones motores básicos. La mejora de la dimensión funcional retroalimenta el resto de dimensiones de la CdV.
– El programa consigue disminuir el riesgo cardiovascular del enfermo. Este efecto se determina por la disminución de las variables antropométricas, principalmente por la disminución del porcentaje de tejido graso de la zona abdominal y la disminución de la tensión arterial.
– El programa tiene un efecto hipotensor más evidente en la población hipertensa. Este efecto es significativo en la presión arterial sistólica y a partir de la sexta semana de programa.
– Los resultados justifican la capacidad de adaptación flexible del programa a los síntomas de incontinencia urinaria, fatiga y dolor. La disminución de la intensidad de los síntomas median en la mejora de la calidad de vida del enfermo.
– Los resultados confirman que el programa de fuerza-resistencia es válido, sostenible y es la mejor forma de intervención destinada al hombre mayor afectado de cáncer de próstata. Este tipo de programa permite el control directo de las constantes vitales, disminuye el riesgo de disfunción cardiovascular, disnea y caída. Además, permite la atención inmediata en caso de urgencia.
– En virtud de los resultados queda demostrado que el ejercicio de fuerza resistencia mejora significativamente la Calidad de Vida (CdV) del enfermo de cáncer de próstata. El resultado viene mediado por la mejora de la dimensión física, incluyendo el dolor, la dimensión funcional, incluyendo la incontinencia urinaria y la dimensión emocional del cuestionario de CdV.
BIBLIOGRAFÍA
AAPHERD (1988). The American Alliance Physical Fitness Education y Assessment Program. American Alliance for Health, Physical Education, Recreation, and Dance (AAPHERD).
ACSM (1998). American College of Sports Medicine Position Stand. Exercise and physical activity for older adults 5. Med.Sci.Sports Exerc., 30, 998-1008.
ACSM (2009). American College of Sports Medicine Position Stand. Exercise and physical activity for older adults 5. Med.Sci.Sports Exerc., 41, 2 459-471.
Andriole, G. L., Crawford, E. D., Grubb, R. L., III, Buys, S. S., Chia, D., Church, T. R. et al. (2009). Mortality results from a randomized prostate-cancer screening trial. N.Engl.J.Med., 360, 1310-1319.
Amado Guirado, E.(2003). Hipertensió arterial. Guies de pràctica clínica i material docent, 6, 1-97.
American Society of Clinical Oncology (2008). An examination into quality of life as a prognostic survival indicator. Results of a meta-analysis of over 10,000 patients covering 30 EORTC clinical trials.J Clin Oncol 26: (May 20 suppl; abstr 9516)
Bellizzi, K. M., Latini, D. M., Cowan, J. E., Duchane, J., y Carroll, P. R. (2008). Fear of Recurrence, Symptom Burden, and Health-Related Quality of Life in Men with Prostate Cancer. Urology.
Bliuc, D., Nguyen, N. D., Milch, V. E., Nguyen, T. V., Eisman, J. A., y Center, J. R. (2009). Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA, 301, 513-521.
Borg, G. (1990). Psychophysical scaling with applications in physical work and the perception of exertion 5. Scand. J.Work Environ.Health, 16 Suppl 1, 55-58.
Brown, E. y Weir, P. (2001). Journal of Exercise Physiology-online [On-line]. Available: http://faculty.css.edu/tboone2/asep/Brown2.doc. Consultado 21/12/2009
Buchner, D. M. (1997). Physical activity and quality of life in older adults. JAMA, 277, 64-66.
Buchner, D. M., Cress, M. E., de Lateur, B. J., Esselman, P. C., Margherita, A. J., Price, R. et al. (1997). The effect of strength and endurance training on gait, balance, fall risk, and health services use in community-living older adults. J.Gerontol.A Biol.Sci.Med.Sci., 52, M218-M224.
Cella, D. F. (1995). Measuring quality of life in palliative care
11. Semin.Oncol., 22, 73-81.
Cella, D. F. & Tulsky, D. S. (1993). Quality of life in cancer: definition, purpose, and method of measurement 2. Cancer Invest, 11, 327-336.
Courneya, K. S. (2001). Exercise interventions during cancer treatment: biopsychosocial outcomes 9. Exerc.Sport Sci.Rev., 29, 60-64.
Courneya, K. S., Segal, R. J., Mackey, J. R., Gelmon, K., Reid, R. D., Friedenreich, C. M. et al. (2007). Effects of aerobic and resistance exercise in breast cancer patients receiving adjuvant chemotherapy: a multicenter randomized controlled trial. J.Clin.Oncol., 25, 4396-4404.
Culos-Reed, S. N., Robinson, J. L., Lau, H., O’Connor, K., y Keats, M. R. (2007). Benefits of a physical activity intervention for men with prostate cancer 2. J.Sport Exerc.Psychol., 29, 118-127.
Departament de Sanitat i Seguretat Social (2008). Pla Director d’Oncologia en Catalunya: 2008-2010. Institut Català d’Oncologia. Accesible en http://www.iconcologia.net/catala/pla_director/index.htm consultado 21/12/2009.
Dunstan, D. W., Daly, R. M., Owen, N., Jolley, D., De Court, Shaw, J. et al. (2002). High-intensity resistance training improves glycemic control in older patients with type 2 diabetes. Diabetes Care, 25, 1729-1736.
Esper, P., Mo, F., Chodak, G., Sinner, M., Cella, D., y Pienta, K. J. (1997). Measuring quality of life in men with prostate cancer using the functional assessment of cancer therapy-prostate instrument. Urology, 50, 920-928.
Evans, W. J. (1998). Exercise and nutritional needs of elderly people: effects on muscle and bone. Gerodontology., 15, 15-24.
Fallowfield, L. (2008). The quality of life: The missing measurement in health care. London: Horizon books.
Ferrans, C. E. (1996). Development of a conceptual model of quality of life
1. Sch Inq.Nurs.Pract., 10, 293-304.
Fiatarone, M. A., O’Neill, E. F., Doyle, N., Clements, K. M., Roberts, S. B., Kehayias, J. J. et al. (1993). The Boston FICSIT study: the effects of resistance training and nutritional supplementation on physical frailty in the oldest old. J.Am.Geriatr.Soc., 41, 333-337.
Fleck, S. y Kraemer, W. (2003). Designing Resistance training Programs. (Champaign ed.) Human Kinetics Publishers.
Godin, G. y Shephard, R. J. (1985). A simple method to assess exercise behavior in the community 27. Can.J.Appl.Sport Sci., 10, 141-146.
Gregg, E. W., Pereira, M. A., y Caspersen, C. J. (2000). Physical activity, falls, and fractures among older adults: a review of the epidemiologic evidence
4. J.Am.Geriatr.Soc., 48, 883-893.
Higano, C. S. (2003). Management of bone loss in men with prostate cancer. J.Urol., 170, S59-S63.
Hsing, A. W. y Devesa, S. S. (2001). Trends and patterns of prostate cancer: what do they suggest? 3. Epidemiol.Rev., 23, 3-13.
Jackson, A. S. y Pollock, M. L. (1978). Generalized equations for predicting body density of men 21. Br.J.Nutr., 40, 497-504.
Jiménez, A. (2008). Application of the 1rm estimation formulas from the rm in bench press in a group of physically active middle-aged women. Journal of Human Sport and Exercise online [On-line].
Joint National Comittee on Detection, E. a. t. o. H. P. J. V. (1997). The Sixth Report of the Joint National Comittee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Arch Intern Med, 21, 2413-2446.
Kamel, H. K. (2003). Sarcopenia and aging. Nutr.Rev., 61, 157-167.
Kamel, H. K., Iqbal, M. A., Mogallapu, R., Maas, D., y Hoffmann, R. G. (2003). Time to ambulation after hip fracture surgery: relation to hospitalization outcomes. J.Gerontol.A Biol.Sci.Med.Sci., 58, 1042-1045.
Kolt, G. S., Hume, P. A., Smith, P., y Williams, M. M. (2004). Effects of a stress-management program on injury and stress of competitive gymnasts. Percept.Mot.Skills, 99, 195-207.
Korfage, I. J., Hak, T., de Koning, H. J., y Essink-Bot, M. L. (2006). Patients’ perceptions of the side-effects of prostate cancer treatment–a qualitative interview study. Soc.Sci.Med., 63, 911-919.
Lander, J. (1985). Maximum based reps. NSCA Journal, 60-61.
Latham, N., Anderson, C., Bennett, D., y Stretton, C. (2003). Progressive resistance strength training for physical disability in older people
6. Cochrane.Database.Syst.Rev., CD002759.
Latham, N. K., Bennett, D. A., Stretton, C. M., y Anderson, C. S. (2004). Systematic review of progressive resistance strength training in older adults 4. J.Gerontol.A Biol.Sci.Med.Sci., 59, 48-61.
Liu, C.; Latham, N.K. (2009). Progressive resistance strength training for improving physical function in older adults (review). Wiley & Sons. NY.
Martínez-Hervas, S. (2008). Perímetro cintura y factores de riesgo cardiovascular. Revista Española de Obesidad, 6, 97-104.
Palmer, M. H., Fogarty, L. A., Somerfield, M. R., y Powel, L. L. (2003). Incontinence after prostatectomy: coping with incontinence after prostate cancer surgery. Oncol.Nurs.Forum, 30, 229-238.
Ringsberg, K., Gerdhem, P., Johansson, J., y Obrant, K. J. (1999). Is there a relationship between balance, gait performance and muscular strength in 75-year-old women? Age Ageing, 28, 289-293.
Salem, G. J., Wang, M. Y., Young, J. T., Marion, M., y Greendale, G. A. (2000). Knee strength and lower- and higher-intensity functional performance in older adults. Med.Sci.Sports Exerc., 32, 1679-1684.
Schroder, F. H., Hugosson, J., Roobol, M. J., Tammela, T. L., Ciatto, S., Nelen, V. et al. (2009). Screening and prostate-cancer mortality in a randomized European study. N.Engl.J.Med., 360, 1320-1328.
Segal, R. J., Reid, R. D., Courneya, K. S., Malone, S. C., Parliament, M. B., Scott, C. G. et al. (2003). Resistance exercise in men receiving androgen deprivation therapy for prostate cancer. J.Clin.Oncol., 21, 1653-1659.
Segal, R.J., Reid,R.D., Courneya K.S., Sigal, R.J., Kenny, G.P., Prud’ Homme D.G., Malone, S.C., et al. (2009). Randomize controlled trial of resistance or aerobic exercise in men receiving radiation therapy for prostate cancer. Journal of clinical oncology 27,3 344-351.
Serdà, B. (2009). Evaluación de los efectos de un programa de ejercicio físico individualizado sobre la calidad de vida, la incontinencia urinaria, la fatiga y la resistencia muscular con enfermos de cáncer de próstata. Tesis Doctoral. Universitat de Girona. http://www.tesisenxarxa.net/TDX-0724109-105044/ Consultado 12/12/2009
Serdà, B., Monreal, P., y Del Valle, A. (in press). Estudio de la relación entre el ejercicio físico, el cáncer y la calidad de vida: una revisión bibliográfica y conceptual. Revista de Psicología del Deporte.
Suh, T. T. y Lyles, K. W. (2003). Osteoporosis considerations in the frail elderly. Curr.Opin.Rheumatol., 15, 481-486.
Tinetti, M. E. y Williams, C. S. (1998). The effect of falls and fall injuries on functioning in community-dwelling older persons. J.Gerontol.A Biol.Sci.Med.Sci., 53, M112-M119.
Traish, A. M., Saad, F., Feeley, R. J., y Guay, A. (2009a). The dark side of testosterone deficiency: III. Cardiovascular disease. J.Androl, 30, 477-494.
Traish, A. M., Saad, F., y Guay, A. (2009b). The dark side of testosterone deficiency: II. Type 2 diabetes and insulin resistance 2. J.Androl, 30, 23-32.
Warburton, D. E., Gledhill, N., y Quinney, A. (2001). Musculoskeletal fitness and health 12. Can.J.Appl.Physiol, 26, 217-237.
Weller, I. M., Thomas, S. G., Gledhill, N., Paterson, D., y Quinney, A. (1995). A study to validate the modified Canadian Aerobic Fitness Test 1 Can.J.Appl.Physiol, 20, 211-221.
Wolff, I., van Croonenborg, J. J., Kemper, H. C., Kostense, P. J., y Twisk, J. W. (1999). The effect of exercise training programs on bone mass: a meta-analysis of published controlled trials in pre- and postmenopausal women. Osteoporos.Int., 9, 1-12.
